Back to top
Regulatorische Expertise & Qualitätserklärung
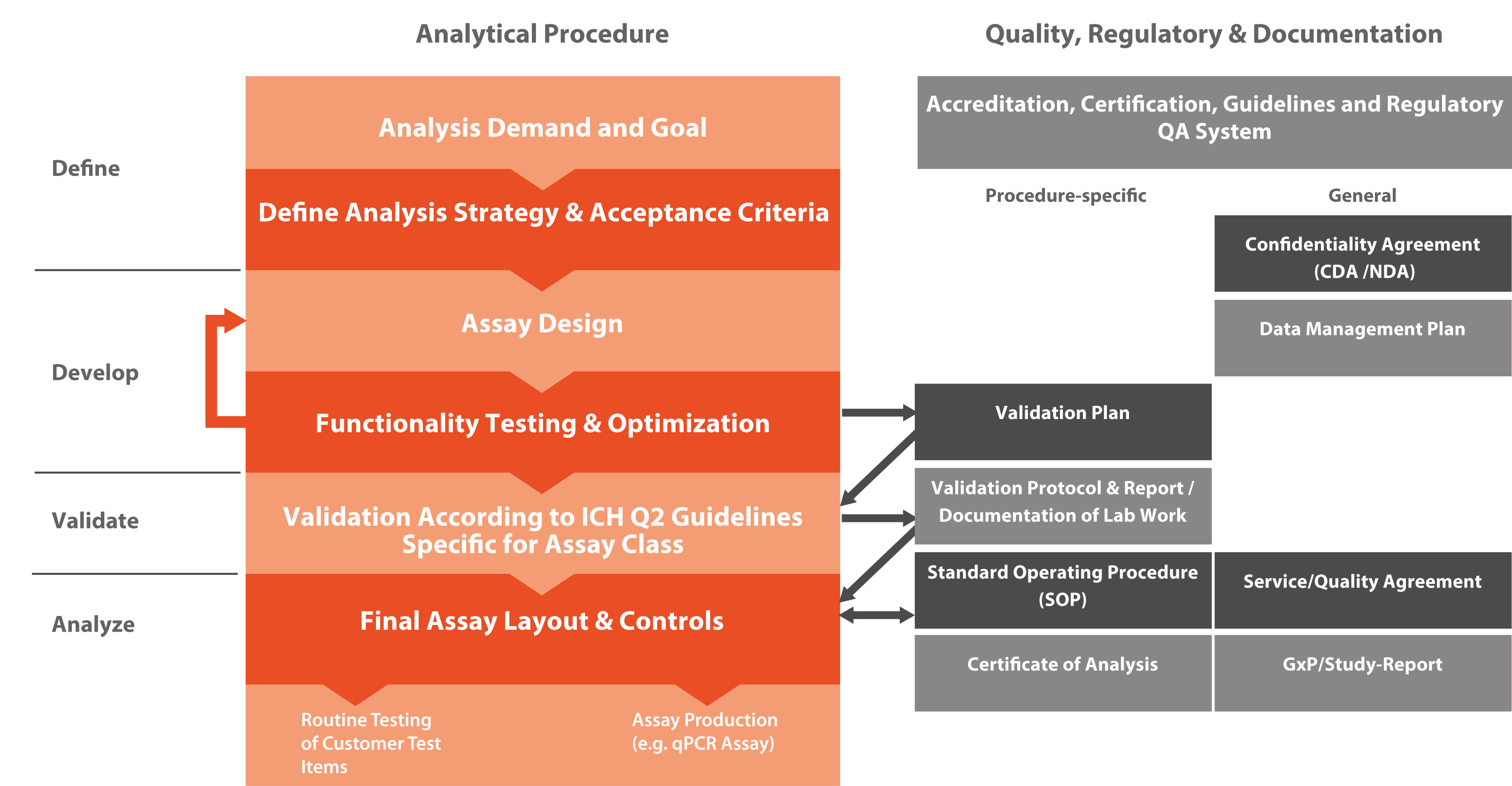
Das International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) hat die Standards für die Entwicklung und Registrierung von Arzneimitteln definiert. In VALIDATION OF ANALYTICAL PROCEDURES: TEXT AND METHODOLOGY (Q2R1) wurden drei Haupttypen von analytischen Verfahren definiert: Identifikationstests (z. B. ein Assay der Klasse A, der zeigt, dass ein bestimmter personalisierter RNA-Impfstoff eine identische Sequenz wie erwartet aufweist), quantitative Tests für bestimmte DNA/RNA-Spezies (z. B. ein Assay der Klasse Bq zur Quantifizierung von Genom-Editierungen in CRISPR/CAS9-Prüfgegenständen) und Grenzwerttests zur Kontrolle von Verunreinigungen (z. B. ein Assay der Klasse Bd, der die Abwesenheit von kontaminierenden RNA/DNA-Spezies in einem Prüfgegenstand nachweist).
(nbsp)
Microsynth hat Erfahrung in der Validierung aller drei Arten von analytischen Verfahren. Alle Validierungstests erfordern hochwertiges Referenzmaterial, das entweder vom Kunden zur Verfügung gestellt oder von Microsynth entwickelt wird. Identifikationstests sind typischerweise einfach, während quantitative Tests für den Gehalt an Verunreinigungen und Grenzwerttests für die Kontrolle von Verunreinigungen typischerweise eine Entwicklungsphase zur Etablierung der entsprechenden Assays erfordern.
Das Ergebnis der Validierung ist ein Bericht, der den endgültigen Assay, die Details des Analyseverfahrens und die Standardarbeitsanweisung (SOP) für die spezifische Analyse definiert. Wichtige Informationen über Kontrollproben und Standards, die in jeder Analyserunde verwendet wurden, werden ebenfalls bereitgestellt. Diese Informationen sind hilfreich, um zu bewerten, ob die Daten jeder Testrunde gültig sind, indem die beobachteten Werte mit den erwarteten Werten der Kontrollen und Standards verglichen werden.
(nbsp)
Microsynth hat Erfahrung in der Validierung aller drei Arten von analytischen Verfahren. Alle Validierungstests erfordern hochwertiges Referenzmaterial, das entweder vom Kunden zur Verfügung gestellt oder von Microsynth entwickelt wird. Identifikationstests sind typischerweise einfach, während quantitative Tests für den Gehalt an Verunreinigungen und Grenzwerttests für die Kontrolle von Verunreinigungen typischerweise eine Entwicklungsphase zur Etablierung der entsprechenden Assays erfordern.
Das Ergebnis der Validierung ist ein Bericht, der den endgültigen Assay, die Details des Analyseverfahrens und die Standardarbeitsanweisung (SOP) für die spezifische Analyse definiert. Wichtige Informationen über Kontrollproben und Standards, die in jeder Analyserunde verwendet wurden, werden ebenfalls bereitgestellt. Diese Informationen sind hilfreich, um zu bewerten, ob die Daten jeder Testrunde gültig sind, indem die beobachteten Werte mit den erwarteten Werten der Kontrollen und Standards verglichen werden.