Back to top
Expertise Réglementaire et Déclaration de Qualité
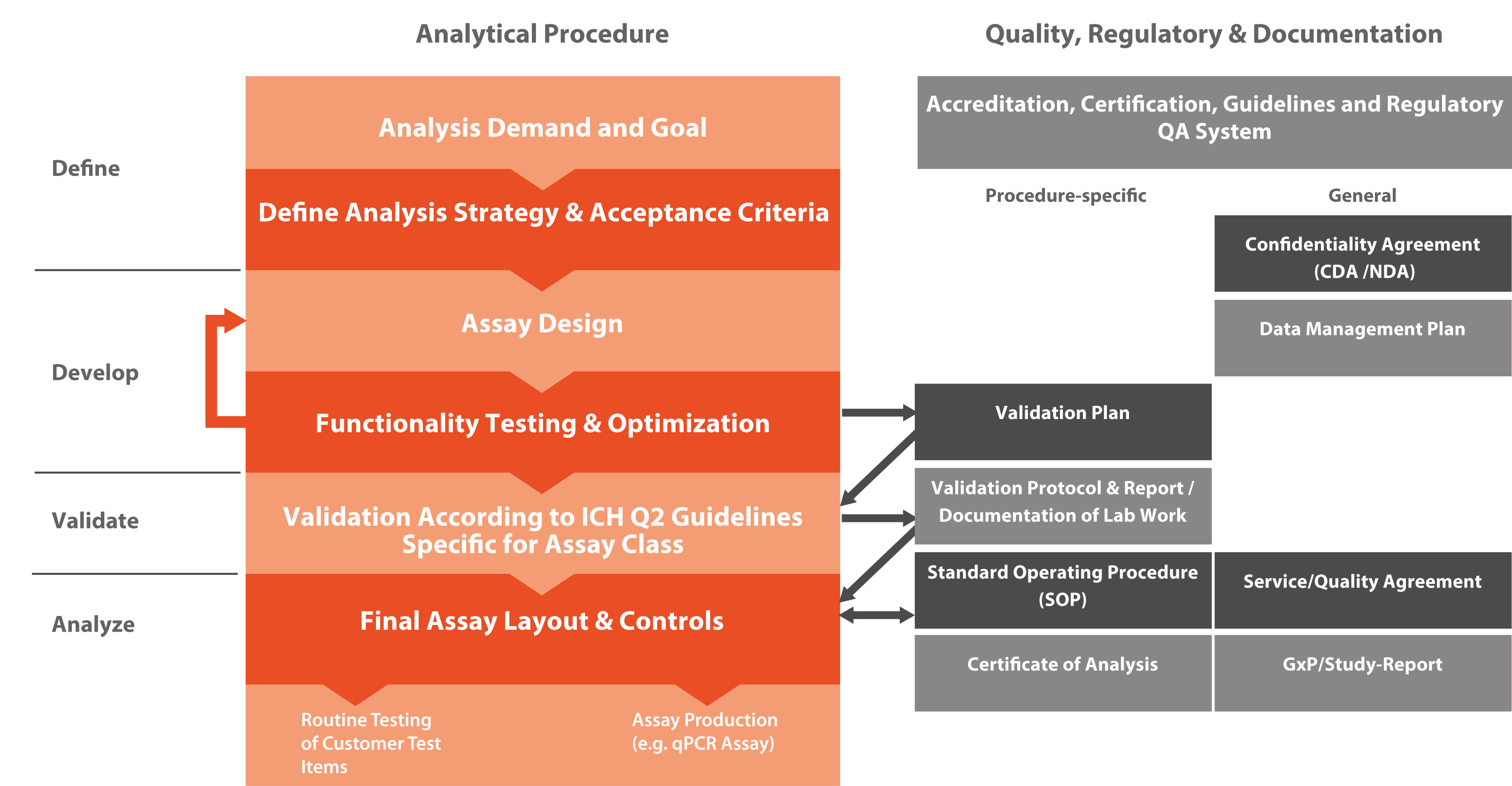
Le Conseil international pour l'harmonisation des exigences techniques applicables aux produits pharmaceutiques à usage humain (ICH) a défini les normes pour le développement et l'enregistrement des médicaments. Dans la section VALIDATION DES PROCÉDURES ANALYTIQUES : TEXTE ET MÉTHODOLOGIE (Q2R1), trois grands types de procédures analytiques ont été définis : les tests d'identification (par exemple un test de classe A montrant qu'un vaccin à ARN personnalisé et particulier a une séquence identique à celle attendue), les tests quantitatifs pour des espèces d'ADN/ARN spécifiques (par exemple un test de classe Bq pour quantifier les modifications du génome dans les éléments de test CRISPR/CAS9), et le test de limite pour le contrôle des impuretés (par exemple un test de classe Bd démontrant l'absence d'espèces d'ARN/ADN contaminantes dans un élément de test).
Microsynth a l'expérience de la validation des trois types de procédures analytiques. Tous les tests de validation nécessitent un matériel de référence de haute qualité, soit fourni par le client, soit développé par Microsynth. Les tests d'identification sont généralement simples, tandis que les tests quantitatifs pour la teneur en impuretés et les tests de limite pour le contrôle des impuretés nécessitent généralement une phase de développement pour établir des tests pertinents.
La validation donnera lieu à un rapport qui définira l'analyse finale, les détails de la procédure d'analyse et la procédure opératoire normalisée (PON) pour l'analyse spécifique. Des informations importantes sur les échantillons de contrôle et les étalons utilisés dans chaque cycle d'analyse sont également fournies. Ces informations sont essentielles pour évaluer si les données de chaque cycle d'analyse sont valides en comparant les valeurs observées aux valeurs attendues des contrôles et des normes.
Microsynth a l'expérience de la validation des trois types de procédures analytiques. Tous les tests de validation nécessitent un matériel de référence de haute qualité, soit fourni par le client, soit développé par Microsynth. Les tests d'identification sont généralement simples, tandis que les tests quantitatifs pour la teneur en impuretés et les tests de limite pour le contrôle des impuretés nécessitent généralement une phase de développement pour établir des tests pertinents.
La validation donnera lieu à un rapport qui définira l'analyse finale, les détails de la procédure d'analyse et la procédure opératoire normalisée (PON) pour l'analyse spécifique. Des informations importantes sur les échantillons de contrôle et les étalons utilisés dans chaque cycle d'analyse sont également fournies. Ces informations sont essentielles pour évaluer si les données de chaque cycle d'analyse sont valides en comparant les valeurs observées aux valeurs attendues des contrôles et des normes.